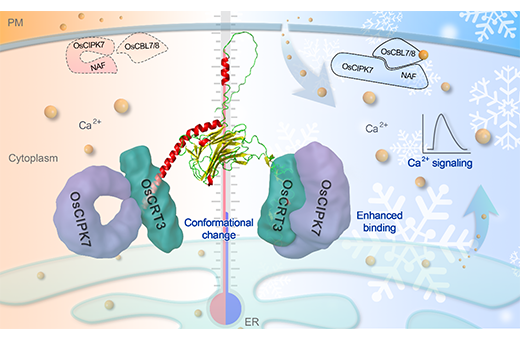
中国科学院植物研究所种康研究组与物理所翁羽翔研究组及其他合作者利用分子遗传学、生理生化和生物物理学等多学科融合策略,研究发现水稻细胞中钙网蛋白复合物OsCRT3(Oryza sativa Calreticulin 3)-OsCIPK7(CBL-Interacting Protein Kinase 7)通过蛋白构象的改变感知低温物理信号,使其转换成细胞内的生化网络信号,这是动植物中首次报道通过蛋白构象改变来感知温度并产生防御反应的研究。该研究组前期研究发现OsCIPK7激酶结构域的单碱基突变体低温耐受性增强,该突变导致激酶活性增强,并且在低温下具有更强的钙离子内流信号(Zhang et al., 2019, JIPB)。分子遗传实验结果显示OsCRT3的T-DNA插入突变体oscrt3-1低温耐受性降低,而超表达株系低温耐受性增强,表明OsCRT3正调控水稻低温耐受性。钙网蛋白OsCRT3定位于内质网,调控低温下细胞质的钙离子信号,在oscrt3-1中,静息状态下的胞质钙离子浓度低于野生型,低温刺激下钙离子浓度的上升幅度也低于野生型。
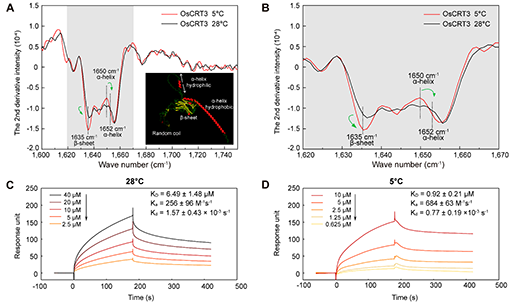
图2: FTIR和SPR实验证明OsCRT3在低温下构象改变并增强与OsCIPK7的结合
傅里叶红外变换(FTIR)实验结果显示,低温下OsCRT3的二级结构发生改变,β折叠增多,同时伴随着部分亲水性α螺旋结构拉伸变为疏水性α螺旋。表面等离子共振(SPR)实验数据显示低温下OsCRT3和OsCIPK7两种蛋白的特异互作增强,表现为在低温下更快的结合速率(Ka)和更慢的解离速率(Kd),结合常数KD(Kd/Ka)减小(图2),进而增强OsCIPK7的激酶活性。而常温下OsCIPK7的NAF/FISL结构域与激酶结构域结合,抑制其酶活。同时,在低温下内质网定位的OsCRT3调控细胞质钙离子浓度上升,细胞膜上的Ca2+受体OsCBL7/8感知钙离子信号,特异地在细胞膜上与OsCIPK7互作,激活下游的信号转导途径,从而赋予水稻寒害耐受性(图3)。综上,该报道首次发现了温度感知的新机制,即通过蛋白的构象改变感知温度信号,并产生下游的效应,具有重要的理论意义,同时也为分子设计育种提供了新的基因模块资源。
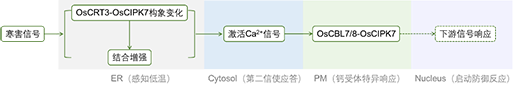
图3: OsCRT3-OsCIPK7-OsCBL7/8信号转导途径示意图
该研究成果于2022年11月7日在线发表于The EMBO Journal。中国科学院植物研究所种康课题组的博士后/特别研究助理郭晓玉博士和已毕业学生张大健博士为该论文的共同第一作者,种康院士为该论文的通讯作者,中国科学院物理研究所的翁羽翔研究员、德国明斯特大学的Jörg Kudla教授、中国农业大学的任东涛教授等人也参与了该项研究。该工作得到了NSFC基础科学中心项目、科技部重点研发计划、中国博士后科学基金和中国科学院特别研究助理资助项目等项目的资助。
文章链接:https://www.embopress.org/doi/full/10.15252/embj.2021110518